
О Центре
команда


Кобалава Жанна Давидовна

Ежова Людмила Георгиевна

Мерай Имад Ахмадович

Артюков Олег Петрович

Цветков Виталий Олегович
Главные исследователи

Кобалава Жанна Давидовна
Опыт работы в клинических исследованиях — 25 лет, более 100 клинических исследований в области кардиологии, терапии, эндокринологии, клинической фармакологии, функциональной диагностики.

Мерай Имад Ахмадович

Артюков Олег Петрович
Опыт работы в клинических исследованиях — 12 лет, участие в 5 клинических исследованиях в области неврологии, кардиологии, нутритивной поддержке. Сертификат по специальности «Неврология» от 2019г. Сертификат по рефлексотерапии от 2018г. Последипломная переподготовка по специальности ЛФК от 2021г. GСP сертификат от 2021г.

Цветков Виталий Олегович
Опыт работы в клинических исследованиях — 17 лет, участие в 17 клинических исследованиях в области хирургии, хирургический инфекции. Сертификат по специальности «Хирургия» от 2020г. GCP сертификат от 2020г.
КЛИНИЧЕСКАЯ БАЗА
Лаборатория
Централизованная клинико-диагностическая лаборатория 24/7
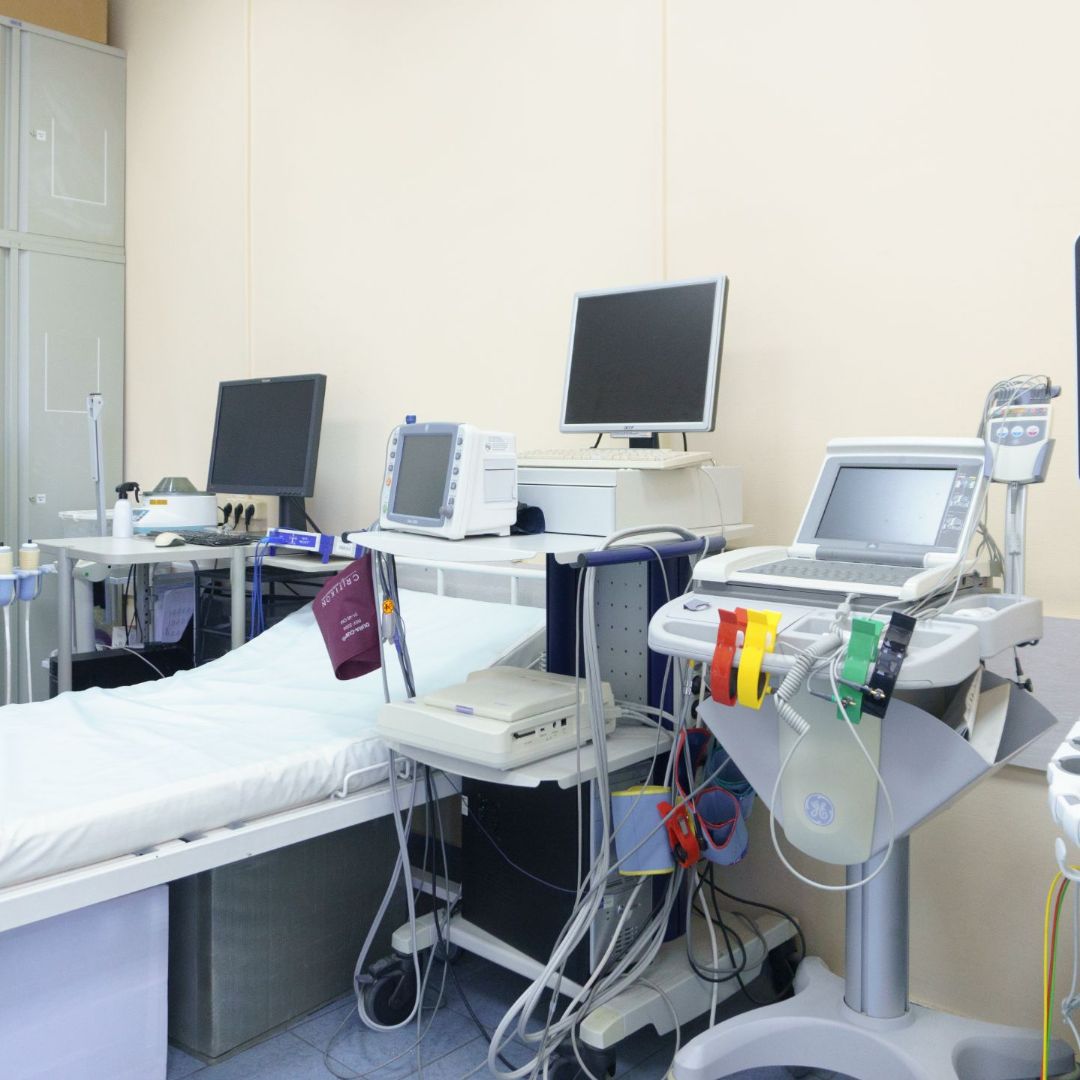
Оборудование
- Ангиографическая система
- Аппараты ультразвуковые
- Аппараты рентгеновские
- Компьютерный томограф
- Лазер хирургический
- Магнитно-резонансный томограф
- Мобильная интраоперационная система
- С-дуга
- Стойки эндоскопические
- Эндохирургические стойки для лапароскопии
- Аппараты для суточного мониторирования артериального давления
- Аппараты для ЭКГ, холтеровского мониторирования
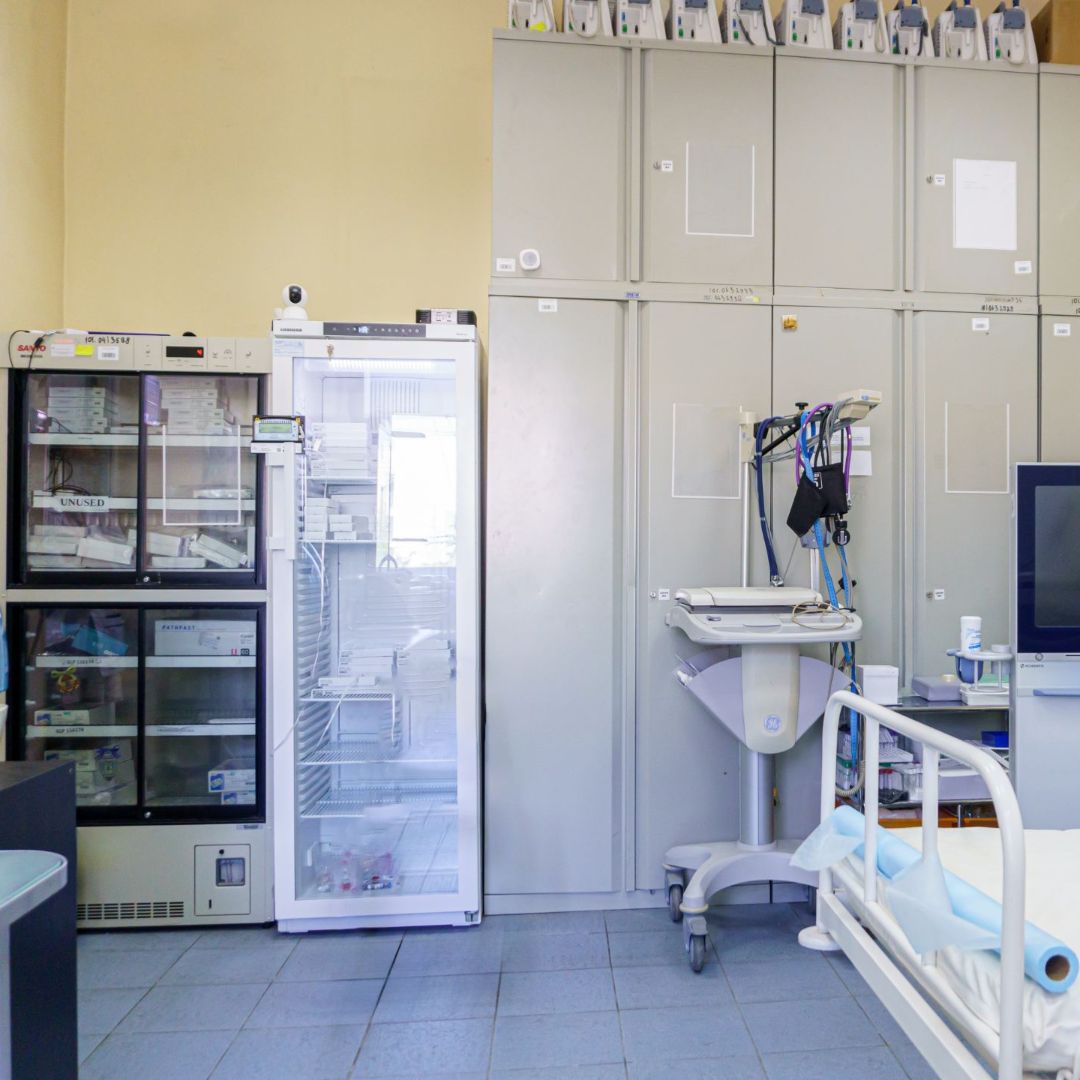
Помещения
Поддержание необходимых и безопасных условий хранения обеспечивается надёжным холодильным и морозильным оборудованием.


СЕРТИФИКАТЫ И ЛИЦЕНЗИИ
- Лицензия на осуществление медицинской деятельности № Л041-00110-77/00575158 от 31.07.2020г.
- Лицензия на осуществление фармацевтической деятельности № Л042-01137-77/00283890 от 27.10.2020г.
- Лицензия на осуществление деятельности по обороту наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений № Л017-01137-77/00146509 от 20.07.2017г.
- Свидетельство об аккредитации на право проведения клинических исследований № 256 от 27.08.2017г.
ИССЛЕДОВАНИЯ
Фазы клинических исследований
Терапевтические исследования
Завершенные исследования
Активные исследования
СПЕЦИАЛИСТАМ
Нормативная база
Международные документы:
- Интегрированное дополнение к ICH E6(R1): Руководство по надлежащей клинической практике E6(R2) / Integrated Addendum to ICH E6(R1): Guideline for Good Clinical Practice E6(R2)
- Регламент (ЕС) N 536/2014 Европейского Парламента и Совета ЕС о клинических испытаниях лекарственных средств, предназначенных для использования человеком, и об отмене директивы 2001/20/ЕС
- Хельсинкская декларация ВМА / Declaration of Helsinki
- Директива 2001/20/ЕС Европейского Парламента и Совета от 4 апреля 2001 года по сближению законодательств, правил и административных постановлений стран-участниц ЕС, касающихся реализации качественной клинической практики при проведении клинических исследований лекарственных средств для применения у людей / Directive 2001/20/EC of the European Parliament and of the Council of 4 April 2001 on the approximation of the laws, regulations and administrative provisions of the Member States relating to the implementation of good clinical practice in the conduct of clinical trials on medicinal products for human use
- Директива Комиссии 2005/28/EC от 8 апреля 2005 г., устанавливающая принципы и детальные правила качественной клинической практики при проведении клинических исследований лекарственных средств для человека, а также требования к процедуре выдачи разрешения на производство или импорт таких средств / Commission Directive 2005/28/EC of 8 April 2005 laying down principles and detailed guidelines for good clinical practice as regards investigational medicinal products for human use, as well as the requirements for authorisation of the manufacturing or importation of such products (Text with EEA relevance)
- Ethical Considerations for Clinical Trials on Medicinal Products Conducted with the Paediatric Population
- Clinical Safety Data Management: Definitions and Standards for Expedited Reporting (ICH E2A)
- Structure and Content of Clinical Study Reports (ICH E3)
- List of fields contained in the 'EudraCT' clinical trials database to be made public, in accordance with Article 57(2) of Regulation (EC) No 726/2004 and its implementing guideline 2008/c168/02
- Положение "О порядке ввоза на таможенную территорию таможенного союза лекарственных средств и фармацевтических субстанций" к п. 2.14 Единого перечня товаров, к которым применяются запреты или ограничения на ввоз или вывоз государствами - членами таможенного союза в рамках Евразийского экономического сообщества в торговле с третьими странами
- Регуляторные документы РФ:
- Федеральные законы
- Федеральный закон от 12.04.2010 года № 61-ФЗ "Об обращении лекарственных средств"
- Налоговый кодекс Российской Федерацией (извлечения), размеры государственной пошлины
- Федеральный закон от 21 ноября 2011 г. № 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (извлечения)
Постановления Правительства РФ
- Постановление Правительства РФ от 01.06.2021 № 853 "Об утверждении Правил ввоза лекарственных средств для медицинского применения в Российскую Федерацию и признании утратившими силу некоторых актов и отдельных положений некоторых актов Правительства Российской Федерации"
- Постановление Правительства РФ от 13.09.2010 № 714 (ред. от 15.10.2014) «Об утверждении типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата»
- Постановление Правительства РФ от 3 сентября 2010 г. № 673 "Об утверждении Правил ввоза на территорию Российской Федерации и вывоза за пределы территории Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения"
- Постановление Правительства от 15 сентября 2008 г. № 688 "Об утверждении перечней кодов медицинских товаров, облагаемых налогом на добавленную стоимость по налоговой ставке 10 процентов".
Приказы
- Приказ Федеральной службы по надзору в сфере здравоохранения от 19. 02.2022 № 1185 «Об утверждении форм проверочных листов (списков контрольных вопросов, ответы на которые свидетельствуют о соблюдении или несоблюдении контролируемым лицом обязательных требований), используемых Федерально службой по надзору в сфере здравоохранения и ее территориальными органами при осуществлении федерального государственного контроля (надзора) в сфере обращения лекарственных средств»
- Приказ Минздрава РФ от 25.08.2021 № 880н "Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче заключений (разрешительных документов) на ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, конкретной партии незарегистрированных лекарственных средств для проведения экспертизы лекарственных средств в целях регистрации и экспертизы лекарственных средств, предназначенных для обращения на общем рынке лекарственных средств в рамках Евразийского экономического союза и (или) Российской Федерации, осуществления государственной регистрации лекарственных препаратов, включения фармацевтической субстанции в государственный реестр лекарственных средств, конкретной партии незарегистрированных лекарственных средств для оказания медицинской помощи по жизненным показаниям конкретного пациента либо оказания медицинской помощи ограниченному контингенту пациентов с редкой и (или) особо тяжелой патологией"
- Приказ Минздрава РФ от 11 января 2021 г. № 4 "О составе Совета по этике"
- Приказ Минздрава России от 29.10.2019 № 900н "Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче заключений (разрешительных документов) на ввоз на территорию Российской Федерации и вывоз за пределы территории Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения"
- Приказ Минздрава России от 07.05.2018 № 202н "Об утверждении Порядка размещения информации о составе Совета по этике, планах его работы и текущей деятельности на официальном сайте Министерства здравоохранения Российской Федерации в информационно-телекоммуникационной сети "Интернет" и о признании утратившим силу пункта 22 Положения о Совете по этике, утвержденного приказом Министерства здравоохранения Российской Федерации от 29.11.2012 г. N 986н"
- Приказ Минздрава России от 19.01.2018 № 20н "Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по выдаче разрешения на проведение клинического исследования лекарственного препарата для медицинского применения"
- Приказ Минздрава РФ от 24.08.2017 г. № 558н "Об утверждении Правил проведения экспертизы лекарственных средств для медицинского применения и особенности экспертизы отдельных видов лекарственных препаратов для медицинского применения (референтных лекарственных препаратов, воспроизведенных лекарственных препаратов, биологических лекарственных препаратов, биоаналоговых (биоподобных) лекарственных препаратов (биоаналогов), гомеопатических лекарственных препаратов, лекарственных растительных препаратов, комбинаций лекарственных препаратов), форм заключений комиссии экспертов"
- Приказ Федеральной службы по надзору в сфере здравоохранения от 15 февраля 2017 г. № 1071 "Об утверждении порядка осуществления фармаконадзора"
- Приказ Минздрава РФ от 1 апреля 2016 г. № 200н "Об утверждении правил надлежащей клинической практики"
- Приложение 13 к Приказу Минпромторга России от 14.06.2013 N 916 (ред. от 18.12.2015) Об утверждении правил надлежащей производственной практики - лекарственные препараты для клинических исследований
- Приказ Минздрава РФ № 986н от 29.11.2012 Об утверждении Положения Совета по этике
- Приказ Минздравсоцразвития РФ от 02.11.2010 № 951н "Об утверждении формы реестра выданных разрешений (решений об отказе в выдаче разрешений) на ввоз на территорию Российской Федерации и вывоз за пределы территории Российской Федерации биологических материалов (образцы биологических жидкостей, тканей, секретов и продуктов жизнедеятельности человека, физиологических и патологических выделений, мазков, соскобов, смывов, микроорганизмов, биопсийный материал), полученных при проведении клинического исследования лекарственного препарата для медицинского применения"
- Приказ Минздравсоцразвития России от 23 августа 2010 г. № 703н г. "Об утверждении формы сообщения о завершении, приостановлении или прекращении клинического исследования лекарственного препарата для медицинского применения"
- Приказ Минздравсоцразвития России № 775н от 31 августа 2010 г. "Об утверждении порядка рассмотрения сообщения о необходимости внесения изменений в протокол клинического исследования лекарственного препарата для медицинского применения"
- Приказ Минздравсоцразвития России от 26 августа 2010 г. № 752н «Об утверждении порядка опубликования и размещения на официальном сайте Министерства здравоохранения и социального развития Российской Федерации в сети «Интернет» перечня медицинских организаций, имеющих право проводить клинические исследования лекарственных препаратов для медицинского применения»
- Приказ Минздравсоцразвития России № 753н от 26 августа 2010 г. "Об утверждении порядка организации и проведения этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения и формы заключения совета по этике"
Национальный стандарт
- Национальный стандарт Российской Федерации ГОСТ Р 52379-2005 "Надлежащая клиническая практика"
Полезные ссылки
- Министерство здравоохранения Российской Федерации → http://www.rosminzdrav.ru
- Росздравнадзор → http://www.roszdravnadzor.ru
- Государственный реестр лекарственных средств → http://www.grls.rosminzdrav.ru
- Реестр выданных разрешений на проведение клинических исследований лекарственных препаратов → https://grls.rosminzdrav.ru/CIPermitionReg.aspx
- Реестр исследователей, проводящих клинические исследования лекарственных препаратов → https://grls.rosminzdrav.ru/CIExperts.aspx?moduleId=2
- Association of Clinical Research Organizations (ACRO) → http://www.acrohealth.org
- The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) → http://www.ich.org
Этический комитет
- ФИО председателя: Микаел Альбертович Саркисян
- контактный телефон: +7 (499) 134-64-79
- адрес месторасположения: 117292, г. Москва, ул. Вавилова, д. 61
- адрес электронной почты: ukb@rudn.ru
- Приказ по ФГАОУ Университетская клиническая больница им. В.В. Виноградова (филиал) федерального государственного автономного образовательного учреждения высшего образования «Российский университет дружбы народов имени Патриса Лумумбы» №135 от 11.11.2024г. «О работе локального этического комитета Университетского клинического центра им. В.В. Виноградова (филиал) РУДН»
Данные Московского городского этического комитета:
- ФИО председателя: Журавлева Марина Владимировна
- телефон: +7 (495) 915-72-64
- адрес месторасположения: 115088, г. Москва, ул. Шарикоподшипниковская, д. 9
- адрес электронной почты: ec@zdrav.mos.ru
Приказ от 25.11.2016 г. № 948 «О Московском городском независимом этическом комитете» на базе Государственного бюджетного учреждения города Москвы «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента Департамента здравоохранения города Москвы»
ПАЦИЕНТАМ
Ответы на часто задаваемые вопросы
ОРГАНИЗАТОРАМ
Статистика медицинской деятельности центра
Ежемесячное количество пролеченных больных в Университетский клинический центр им. В. В. Виноградова (филиал) РУДН, в среднем составляет около 4000 пациентов.
В гинекологическое отделение ежемесячно госпитализируется, в среднем, около 460 пациенток, в кардиологические отделения – более 600 пациентов, в неврологическое отделение более 420, в отделение гнойной хирургии – около 250, в терапевтическое отделение – около 240, в эндокринологическое отделение – более 110, в травматологическое – около 290, в урологическое отделение – боле 250, в хирургическое – около 480, в отделение сосудистой хирургии – более 85, в отделение медицинской реабилитации – около 40.
Всего оперируется более 1500 больных в месяц, в том числе в гинекологическом отделении - 370,в отделении гнойной хирургии – около 240, в отделении сосудистой хирургии – более 45, в травматологическом отделении – около 230, в урологическом более 200, в хирургическом – около 300 операций в месяц.
Наиболее частые диагнозы при госпитализации: инфаркт мозга, другие цереброваскулярные болезни, эпизодические и пароксизмальные расстройства, ишемическая болезнь сердца, болезни, характеризующиеся повышенным кровяным давлением, сердечная недостаточность, фибрилляция и трепетание предсердий, сахарный диабет, хронические болезни нижних дыхательных путей, болезни пищевода, желудка и двенадцатиперстной кишки, грыжи, болезни желчного пузыря, желчевыводящих путей и поджелудочной железы, инфекции кожи и подкожной клетчатки, невоспалительные болезни женских половых органов, мочекаменная болезнь, болезни мужских половых органов, травмы.
Перечень оперативных вмешательств:
Эндопротезирование тазобедренного и коленного суставов, различные виды остеосинтеза,аппендэктомия лапароскопическая, все виды вмешательств на внепеченочных желчных протоках, дренирующие и резекционные вмешательства на поджелудочной железе при осложнённом хроническом панкреатите и осложнённых опухолях, включая тотальную дуоденопанкреатэктомию, резекции различных отделов ободочной кишки при дивертикулезе и осложнённых опухолях, в том числе лапароскопическим способом, лапароскопическая спленэктомия, лапароскопическая дистальная резекция поджелудочной железы, лапароскопическое вмешательство при грыжах пищеводного отверстия диафрагмы, все виды операций на желудке при осложнённой язвенной болезни и осложнённых опухолях от ушивания перфорации до гастрэктомии, операции при кишечных свищах, реконструктивные операции при кишечных стомах, включая лапароскопические варианты.
Грыжесечение при всех видах грыж брюшной стенки, в том числе лапароскопическим доступом с использованием современных модификаций. Операции при стенозе сонных артерий, при облитерирующем атеросклерозе дистального отдела аорты, подвздошных артерий и артерий нижних конечностей, включая эндоваскулярные вмешательства, флебэктомия, резекция аневризмы аорты с протезированием при разрыве аневризмы, флебэктомия.Транслюминальная баллонная ангиопластика и стентирование коронарных артерий.Перкутанная нефролитотрипсия с литоэкстракцией (нефролитолапаксия), трансуретральная эндоскопическая уретеролитотрипсия, лапароскопическая пластика передней брюшной стенки при грыжах, кольпоперинеоррафия и леваторопластика.
Возможности центра
Имеются и обеспечиваются:
- места для хранения материалов исследования
- места хранения исследуемого препарата
- обеспечение холодовой цепи
- контроль температуры и влажности
- хранение материала в соответствии с требованиями производителя
- отдельное помещение архив документации исследовательского центра
- обеспечение доступа в помещение
Отправить запрос на проведение клинического исследования
Отправить запрос на проведение клинического исследования в медицинской организации можно по адресу электронной почты ukb@rudn.ru